This site is not complete. The work to converting the volumes of സര്വ്വവിജ്ഞാനകോശം is on progress. Please bear with us
Please contact webmastersiep@yahoo.com for any queries regarding this website.
Reading Problems? see Enabling Malayalam
കളിമണ് ധാതുക്കള്
സര്വ്വവിജ്ഞാനകോശം സംരംഭത്തില് നിന്ന്
കളിമണ് ധാതുക്കള്
Clay Minerals
കളിമണ്ണിന് സവിശേഷ സ്വഭാവങ്ങള് പ്രദാനം ചെയ്യുന്ന ജലയോജിത അലുമിനിയം സിലിക്കേറ്റ് ധാതുക്കള്. ആര്ദ്രാവസ്ഥയില് പ്ലാസ്തികത പ്രദര്ശിപ്പിക്കുന്ന കളിമണ് ധാതുപരലുകള്ക്ക് അഞ്ച് മൈക്രാണിലധികം വലുപ്പമുണ്ടാവില്ല. കളിമണ്ണിലെ മുഖ്യഘടകധാതുക്കളായ ഇവയോടൊപ്പം സര്വസാധാരണമായി മറ്റു ചില അജൈവധാതുക്കളും കാണപ്പെടുന്നു. യാന്ത്രികവിശ്ലേഷണം (mechanical analysis) നടത്തുമ്പോള് മണ്ണിലും അവസാദശിലകളിലും മറ്റും കാണപ്പെടുന്ന അതിസൂക്ഷ്മപരല് രൂപത്തിലുള്ള ധാത്വംശങ്ങളെ മൊത്തത്തില് വ്യവഹരിക്കാനും കളിമണ് ധാതുക്കള് എന്ന സംജ്ഞ ഉപയോഗിക്കുന്നു.
ചൂടാക്കുമ്പോള് ജലാംശം നഷ്ടപ്പെടുന്ന പരല് സഞ്ചയങ്ങളായി അവസ്ഥിതമാവുന്ന വലിയൊരു കുടുംബമാണ് കളിമണ് ധാതുക്കളുടേത്. കളിമണ് ധാതുകണികകളുടെ വലുപ്പം കൊളോയ്ഡ് അവസ്ഥ മുതല് സൂക്ഷ്മദര്ശിനിയിലൂടെ കാണാവുന്നതുവരെയാകാം. ഏതാനും ആങ്സ്റ്റ്രം മാത്രം വലുപ്പമുള്ള പാളികളോ സൂചികളോ പോലുള്ള ധാതുപരലുകള് കൂടിച്ചേര്ന്ന് മൈക്രാണുകള് മാത്രം വലുപ്പവും പുസ്തകത്തിന്റെയോ തന്തുവിന്റെയോ രൂപവും ഉള്ള പരല് സഞ്ചയങ്ങളായാണ് കളിമണ് ധാതുക്കള് അവസ്ഥിതമായിരിക്കുന്നത്. ജാലികഘടനയില് ധനഅയോണുകള് പ്രതിസ്ഥാപനം ചെയ്യപ്പെടുന്നത് സര്വസാധാരണമാണ്. തന്മൂലം കളിമണ് ധാതുക്കള്ക്ക് നിശ്ചിതമായ രാസ സംരചനയില്ല; ചില കളിമണ് ധാതുക്കള് നിശ്ചിതമായ ഭൗതികഘടനയും ആര്ജിച്ചിട്ടില്ലാത്തവയാണ്. ക്ഷാരങ്ങളും ക്ഷാരമൃത്തുകളും ചില കളിമണ് ധാതുക്കളിലെ പ്രമുഖ ഘടകങ്ങളാണ്. മഗ്നീഷ്യം, ഇരുമ്പ് എന്നീ മൂലകങ്ങളുടെ അയോണുകള് ഒറ്റയ്ക്കോ ഒരുമിച്ചോ ചില കളിമണ് ധാതുക്കളില് അലുമിനിയത്തെ ഭാഗികമായോ പൂര്ണമായോ പ്രതിസ്ഥാപനം ചെയ്യുക സാധാരണമാണ്.
രാസാപക്ഷയവും ഉഷ്ണജലീയ പ്രക്രിയകളും ഹേതുകമായി രൂപം കൊള്ളുന്ന കളിമണ്ണ് രാസഭൗതിക പരിസ്ഥിതികള്ക്കനുസരണമായി വ്യത്യസ്ത കളിമണ് ധാതുക്കളായിരിക്കും ഉള്ക്കൊള്ളുക. അപക്ഷയജന്യമായ കളിമണ് ധാതുക്കള് പഴക്കമേറിയതും നവീനവുമായ സമുദ്രാന്തരിത അവസാദനിക്ഷേപങ്ങളിലും ചെളിക്കല്ല്, ഷെയ്ല് എന്നിവയിലും മണ്ണിലും ധാരാളമായുണ്ട്. ആഗ്നേയ പ്രക്രിയകളോടനുബന്ധിച്ച് മുകളിലേക്കുയരുന്ന ബാഷ്പവും താപലായനികളും സൃഷ്ടിക്കുന്ന കളിമണ് ധാതുക്കള് സാധാരണയായി ലോഹഅയിരുനിക്ഷേപങ്ങ(metallic ore deposits)ളോടൊപ്പം അവസ്ഥിതമാവുന്നു. രാസഭൗതികസ്വഭാവവിശേഷങ്ങളെ ആസ്പദമാക്കി കളിമണ് ധാതുക്കളെ ഒന്പതു വിഭാഗങ്ങളായി തിരിച്ചിരിക്കുന്നു. കളിമണ്ധാതുക്കള്ക്ക് തനതായുള്ള സ്വഭാവവിശേഷങ്ങള്ക്കനുസൃതമായി വ്യത്യസ്തവും വിപുലവുമായ ഉപയോഗസാധ്യതകളുണ്ട്. വിരഞ്ജക മൃത്തിക (bleaching earth), അയോണ്വിനിമയകാരികള്, രാസത്വരക ക്ഷാരകങ്ങള് (catalysts bases), ഫില്ലര്, എക്സ്റ്റന്ഡര് എന്നീ നിലകളിലും സെറാമിക്സ്, സിമന്റ്, ഡ്രില്ലിങ് മഡ്, പ്ലാസ്റ്റര്, പ്ലാസ്റ്റിക്, പെയിന്റ് തുടങ്ങിയവയുടെ നിര്മാണരംഗങ്ങളിലും സര്വോപരി ഇഷ്ടിക, ഓട്, കുഴലുകള് തുടങ്ങിയവയുടെ നിര്മാണത്തിലും കളിമണ് ധാതുക്കള് ഉപയോഗപ്പെടുന്നു.
രാസപരമായും ഘടനാപരമായും അതീവ സാജാത്യം പുലര്ത്തുന്ന കളിമണ് ധാതുക്കളെ തിരിച്ചറിയുന്നതിന് എക്സ്റേ വിഭംഗനപ്രവിധികളോ (X-ray diffraction techniques), താപമാനാന്തര വിശ്ലേഷണമോ (differential thermal analysis), ഇലക്ട്രാണ് മൈക്രാസ്കോപ്പോ ഉപയോഗപ്പെടുത്തേണ്ടത് അനിവാര്യമാണ്. തന്മൂലം കളിമണ് ധാതുക്കളെക്കുറിച്ചുള്ള പഠനം കഴിഞ്ഞ അഞ്ചു പതിറ്റാണ്ടു കാലം കൊണ്ടാണ് ഊര്ജിതമായത്. ഇന്നു കളിമണ്ധാതുവിജ്ഞാനീയം (Clay mineralogy) എന്നൊരു പഠനശാഖ തന്നെ വികസിച്ചിരിക്കുന്നു. കളിമണ് ധാതുക്കളുടെ രൂപീകരണം, സ്വഭാവം, സംയോഗം, പരല്ഘടന, വര്ഗീകരണം, അവസ്ഥിതി, വിതരണം തുടങ്ങി ഇവയോടു ബന്ധപ്പെട്ട വസ്തുതകളെയെല്ലാം കുറിച്ചുള്ള പഠനമാണിത്. കളിമണ് ധാതുക്കളുടെ ഒറ്റപ്പെട്ട സ്വഭാവവിശേഷങ്ങളും അവയോടു ബന്ധപ്പെട്ട മറ്റു പ്രശ്നങ്ങളും ധാതു വിജ്ഞാനീയത്തിലെ കളിമണ് ധാതുവിജ്ഞാനീയമെന്ന ശാഖയുടെ വികാസത്തിന് ആക്കം കൂട്ടുന്നു.
രൂപീകരണം. കളിമണ് ധാതുക്കളെല്ലാം തന്നെ പരീക്ഷണശാലയില് സൃഷ്ടിക്കപ്പെട്ടിട്ടുണ്ട്. താരതമ്യേന താഴ്ന്ന മര്ദോഷ്മാവില്, ഓക്സൈഡുകളും ഹൈഡ്രാക്സൈഡുകളും കലര്ന്ന രാസമിശ്രിതത്തില് നിന്ന് ഹാല്ലോയ്സൈറ്റ് (Halloysite) ഒഴികെയുള്ള കളിമണ് ധാതുക്കളെല്ലാം ഉണ്ടാക്കാന് ശാസ്ത്രജ്ഞര്ക്കു കഴിഞ്ഞു. ഈ പരീക്ഷണനിരീക്ഷണങ്ങളില് നിന്ന് വ്യത്യസ്ത കളിമണ് ധാതുക്കളുടെ രൂപീകരണ പരിസ്ഥിതികളെ സംബന്ധിച്ച് വ്യക്തമായി മനസ്സിലാക്കാനും സാധിച്ചു. രാസാപക്ഷയത്തിനു വിധേയമാവുമ്പോള് സാധാരണയായി അധിസിലികശിലകളില് (acid rocks) നിന്ന് കയോലിനൈറ്റ് ധാതുക്കളും അല്പസിലികശില(basic rock)കളില് നിന്ന് സ്മെക്ടൈറ്റ് ധാതുക്കളും രൂപംകൊള്ളുന്നു.
അറ്റാപല്ജൈറ്റ്, പലിഗോര്സ്കൈറ്റ്, വെര്മിക്കുലൈറ്റ് എന്നീ ധാതുക്കളൊഴികെയുള്ള കളിമണ് ധാതുക്കളെല്ലാം തന്നെ ഉഷ്ണജലീയ നിക്ഷേപങ്ങളോടനുബന്ധിച്ച് കാണപ്പെട്ടിട്ടുണ്ട്. മണ്ണും ശിലകളും രാസാപക്ഷയത്തിനു വിധേയമാവുമ്പോള് സ്രാതസ്സ്, കാലാവസ്ഥ, ഭൂപ്രകൃതി, സസ്യജാലം, സമയദൈര്ഘ്യം തുടങ്ങിയ ഘടകങ്ങളെ ആസ്പദമാക്കി വ്യത്യസ്ത കളിമണ് ധാതുക്കള് ഉരുത്തിരിയുന്നു. ക്ഷാരങ്ങളും ക്ഷാരമൃത്തുകളും പ്രവാഹജലത്താല് നിക്ഷാളനം ചെയ്യപ്പെടുകയും അവയുള്ക്കൊള്ളുന്ന ധാതുക്കള് വിഘടിതമാവുകയും ചെയ്യുന്നു. അവശേഷിക്കുന്ന അലൂമിനയും (Al2O3) സിലിക്കയും (SiO2) പരിവര്ത്തനമേഖലയില് നിന്നു മാറ്റപ്പെടുന്നു. നോ: മണ്ണ്
സര്വസാധാരണമായ കളിമണ് ധാതുക്കള് (കയോലിനൈറ്റ് ധാതുക്കള്) ഫെല്സ്പാര്, ഫെല്സ്പതോയ്ഡ് തുടങ്ങിയ സിലിക്കേറ്റ് ധാതുക്കളുടെ ഉഷ്ണജലീയമോ, അപക്ഷയ ഫലമായുണ്ടാകുന്നതോ ആയ പരിവര്ത്തനത്തിലൂടെയാണ് ഉരുത്തിരിയുന്നത്; ഇതിനോടൊപ്പം ക്വാര്ട്ട്സ്, ഇരുമ്പിന്റെ ഓക്സൈഡുകള്, പൈറൈറ്റ്, സിഡറൈറ്റ്, അഭ്രം തുടങ്ങിയ ധാതുക്കളും അവശേഷിക്കാം. കയോലിനൈറ്റിന്റെ രൂപീകരണത്തിന് ക്ഷാരങ്ങളുടെ അഭാവം അനിവാര്യമാണ്. ഫെല്സ്പാര് ധാതുക്കളില് നിന്ന് ഉരുത്തിരിയുന്ന പ്രാഥമികവും ദ്വിതീയവുമായ അഭ്രം തന്തുരൂപത്തിലുള്ള കയോലിനൈറ്റായി പരിണമിക്കുന്നു. ഷെയ്ല്, ചുണ്ണാമ്പുകല്ല് തുടങ്ങിയ അവസാദശിലകളിലും മറ്റും സര്വസാധാരണമായുള്ള കളിമണ് ധാതുവിഭാഗമായ ഇല്ലൈറ്റ് ധാതുക്കള് രണ്ടു വിധത്തില് രൂപം കൊള്ളുന്നു; ഇവ ഭൂതലത്തിലെ അപക്ഷയ ഫലമായി മറ്റു കളിമണ് ധാതുക്കളോടൊപ്പവും അവസാദം ദൃഢീഭവിക്കുമ്പോള് (diagenesis) അതിലുള്ള മറ്റു കളിമണ് ധാതുക്കളുടെ തന്നെ പരിണാമത്തിലൂടെയും ഉരുത്തിരിയാം. സ്മെക്ടൈറ്റ് ധാതുക്കള് ചില സവിശേഷ സാഹചര്യങ്ങളില് പൊട്ടാസിയത്തെ അധിശോഷണം ചെയ്യുന്നതിലൂടെയും ഇല്ലൈറ്റ് രൂപം കൊള്ളാം. മസ്കവൈറ്റിന്റെ വിഘടനം മൂലവും കൊളോയ്ഡ് അവസ്ഥയിലുള്ള അവസാദത്തിന്റെ പുനഃക്രിസ്റ്റലീകരണം (recrystallization) മൂലവും ഇല്ലൈറ്റ് ധാതുക്കള് ഉരുത്തിരിയുന്നു. ഉഷ്ണജലീയമായ ഇല്ലൈറ്റ് നിക്ഷേപങ്ങള് ഉഷ്ണഉറവകള്(hot springs)ക്കു ചുറ്റിലും അയിരുനിക്ഷേപങ്ങളോടൊപ്പവും കാണപ്പെടുന്നു; ക്ഷാരീയ പരിസ്ഥിതിയും അലുമിനിയത്തിന്റെയും പൊട്ടാസിയത്തിന്റെയും ഉയര്ന്ന സാന്ദ്രതയും ഇല്ലൈറ്റ് ധാതുക്കളുടെ രൂപീകരണത്തിന് സഹായകമാണ്.
അഗ്നിപര്വതച്ചാരം, ടഫ് എന്നിവയ്ക്കു പുറമേ ചില അല്പസിലിക ശിലകളില് നിന്നും പരിണമിച്ചുണ്ടാകുന്ന സ്മെക്ടൈറ്റ് ധാതുക്കള് ബന്റൊണൈറ്റ്കളിമണ്ണിലെ മുഖ്യധാതുക്കളാണ്. ക്രിസ്റ്റബൊളൈറ്റ്, സിയൊളൈറ്റ് തുടങ്ങിയ ദ്വിതീയ ധാതുക്കളും ബയോടൈറ്റ്, ക്വാര്ട്ട്സ്, ഫെല്സ്പാര്, സിര്കോണ് തുടങ്ങിയ ധാതുക്കളും ഇതോടൊപ്പം കാണപ്പെടുന്നു. സ്മെക്ടൈറ്റ് ധാതുക്കളുടെ ആധിക്യമുള്ള കളിമണ്ണിനമായ അലക്കുമണ്ണി(Fuller's earth)ന്റെ ഏറിയ പങ്കും അല്പസിലികശിലകളുടെ രാസാപക്ഷയത്തിലൂടെ രൂപം കൊണ്ടവയാണ്. ഉഷ്ണജലീയപരിവര്ത്തിത ധാതുക്കളായി അയിരു നിക്ഷേപങ്ങളോടൊപ്പവും ഉഷ്ണ ഉറവകള്, ഗയ്സര് എന്നിവയ്ക്കു ചുറ്റിലും ഇതിനുപുറമേ ക്ലോറൈറ്റ് നിക്ഷേപങ്ങളോടൊപ്പവും സ്മെക്ടൈറ്റ് ധാതുക്കള് കാണപ്പെടാം. പരിവര്ത്തനമേഖലയില് മഗ്നീഷ്യം, കാല്സിയം, പൊട്ടാസിയം എന്നിവയുടെ ലഭ്യതയാണ് സ്മെക്ടൈറ്റ് ധാതുക്കളുടെ രൂപീകരണത്തിന് സൗകര്യമുണ്ടാക്കുന്ന പ്രാഥമികഘടകം; എന്നാല് സുഗമമായ അപവാഹം പരിവര്ത്തനമേഖലയില് നിന്ന് ഇവയെ നിക്ഷാളനം ചെയ്യുന്ന പരിസ്ഥിതിയില് കയോലിനൈറ്റ് രൂപംകൊള്ളുന്നു. ഒലിവിന് ധാതുവിന്റെ പരിവര്ത്തനം മൂലവും സ്മെക്ടൈറ്റ് ധാതുക്കള് രൂപം കൊള്ളാറുണ്ട്. ബയോടൈറ്റ് ധാതുവിന്റെ രൂപാന്തരണം മൂലവും, അപക്ഷയ, ഉഷ്ണജലീയ പ്രക്രിയകളുടെ ഫലമായും വെര്മിക്കുലേറ്റ് ധാതു രൂപം കൊള്ളുന്നു. പൈറോക്സിനൈറ്റ്, പെരിഡൊടൈറ്റ്, ഡുണൈറ്റ് തുടങ്ങിയ അല്പസിലിക, അത്യല്പസിലികഅന്തര്വേധ(intrusive)ങ്ങളും അധിസിലികഅന്തര്വേധങ്ങളും തമ്മില് സ്പര്ശിക്കുന്ന ഭാഗങ്ങളിലാണ് മുഖ്യമായും വെര്മിക്കുലൈറ്റ് ധാതു രൂപം കൊള്ളുന്നത്. അപക്ഷയത്തിലൂടെ വ്യുത്പന്നമാക്കപ്പെടുന്നവ മണ്ണിലും മറ്റും കാണപ്പെടുന്നു.
വര്ഗീകരണം. പരല്ഘടന അഥവാ ജാലികഘടന, രാസസംയോഗം എന്നിവയെ ആധാരമാക്കി കളിമണ് ധാതുക്കളെ ഒന്പതു വിഭാഗങ്ങളായി തിരിച്ചിരിക്കുന്നതാണ് പരക്കെ അംഗീകരിക്കപ്പെട്ടിരിക്കുന്ന വര്ഗീകരണ പദ്ധതി. ചില സാഹചര്യങ്ങളില്, പരല്ഘടനയില്ലായ്മയും ഒരു ധാതുവില് നിന്ന് മറ്റൊന്നിലേക്കുള്ള പരിണാമവും ധാതുക്കളെ തിരിച്ചറിയുന്നതിനും അവയെ തരംതിരിക്കുന്നതിനും വിഷമം സൃഷ്ടിക്കുന്നു. പരല്രൂപമില്ലാത്തവയെന്നും ഉള്ളവയെന്നും കളിമണ് കണികകളെ പൊതുവില് രണ്ടായി തിരിക്കാം. പരല്രൂപമില്ലാത്ത (amorphous) അജൈവഘടകത്തെ അല്ലോഫേന് (Allophane) എന്നു വിശേഷിപ്പിക്കുന്നു. വ്യക്തമായ പരല്രൂപമുള്ളവയെ ജാലികഘടന അടിസ്ഥാനമാക്കി എട്ട് വിഭാഗങ്ങളായി തിരിച്ചിരിക്കുന്നു. ജാലികഘടനാപരമായി ഇവയില് രണ്ടുവിഭാഗങ്ങളില് രണ്ടു സ്തരങ്ങളും (two layer type) മൂന്നു വിഭാഗങ്ങളില് മൂന്നു സ്തരങ്ങളും (three layer type) ഒന്നില് സമ്മിശ്രഘടനയും (mixed layer type) ഒന്നില് ചങ്ങലപോലുള്ള ഘടനയുമാണുള്ളത്. കൂടാതെ ഒന്നില്ക്കൂടുതല് കളിമണ് ധാതുക്കളുടെ ഘടനകളുടെ സമുച്ചയ രൂപങ്ങളും ദൃശ്യമാണ്.
നാമപദ്ധതി അല്ലോഫേന്. ചില കളിമണ്ണിനങ്ങളില് കാണപ്പെടുന്ന അജൈവഅമോര്ഫസ് ഘടകങ്ങളാണ് അല്ലോഫേന്. അല്ലോഫേന് ഘടകത്തില്, അധികപങ്കും അതിസൂക്ഷ്മപരല് ഘടനയുള്ളവയാണ്. എക്സ്റേ വിഭംഗന പ്രവിധിയിലൂടെ ഘടന വെളിപ്പെടുന്നില്ലെങ്കിലും ഇലക്ട്രാണ് മൈക്രാസ്കോപ്പിലൂടെയുള്ള നിരീക്ഷണത്തില് ഘടന ദൃശ്യമാണ്. തന്മൂലം രാസഘടന കണക്കിലെടുക്കാതെ തന്നെ, എക്സ്റേ വിഭംഗനത്തിനു വെളിപ്പെടുത്താനാവാത്ത സൂക്ഷ്മഘടനയോടു കൂടിയതും ഒട്ടുംതന്നെ പരല്ഘടനയില്ലാത്തതുമായ അജൈവ കളിമണ് ഘടകങ്ങളെ മൊത്തത്തില് അല്ലോഫേന് എന്നു വിശേഷിപ്പിക്കുന്നു.
കയോലിനൈറ്റ് വിഭാഗം. കയോലിനൈറ്റ് ധാതുക്കളാണ് ഏറ്റവും പ്രമുഖ കളിമണ് ധാതുക്കള്. കയോലിനൈറ്റ്, ഡിക്രറ്റ്, നക്രറ്റ് എന്നിവയാണ് ഈ വിഭാഗത്തിലുള്ള മൂന്നു ധാതുക്കള്. അനാക്സൈറ്റ് എന്നൊരു ധാതു കൂടിയുള്ളതായി ആദ്യകാലങ്ങളില് കരുതിയിരുന്നു. എന്നാല് ഘടനാപരമായി കയോലിനൈറ്റ്, ക്വാര്ട്ട്സ് എന്നീ ധാതുക്കളുടെ ഒരു മിശ്രരൂപമാണ് അനാക്സൈറ്റ് എന്നു വിശേഷിപ്പിക്കപ്പെട്ടിരുന്നതെന്ന് പില്ക്കാല നിരീക്ഷണങ്ങള് വെളിവാക്കി. ഹാല്ലോയ്സൈറ്റ്, മെറ്റാഹാല്ലോയ്സൈറ്റ് എന്നീ ധാതുക്കള്ക്ക് കയോലിനൈറ്റിനോട് രാസികമായി സാജാത്യമുണ്ടെങ്കിലും ഇവയെ മറ്റൊരു കളിമണ് ധാതുവിഭാഗമായി കണക്കാക്കിവരുന്നു. നോ: കയോലിനൈറ്റ്; കയോലിന്
ഹാല്ലോയ്സൈറ്റ് വിഭാഗം. രാസികമായി കയോലിനൈറ്റ് വിഭാഗത്തിനു സമാനമാണെങ്കിലും ഘടനാപരമായി വ്യത്യസ്തമായ കളിമണ് ധാതുവിഭാഗമാണിത്. ഇതില് ജലാംശം കൂടുതലായുള്ക്കൊള്ളുന്നതും അല്ലാത്തതുമായി രണ്ടിനം ധാതുക്കളുണ്ട്. ആദ്യത്തേതിനെ ഹാല്ലോയ്സൈറ്റ് അഥവാ എന്ഡല്ലൈറ്റ് എന്നും രണ്ടാമത്തേതിനെ മെറ്റാഹാല്ലോയ്സൈറ്റ് എന്നും വിശേഷിപ്പിച്ചു കാണുന്നു. പുനരവശോഷണം നടത്താനാവാത്ത വിധം 600Cല് തന്നെ ഹാല്ലോയ്സൈറ്റ് നിര്ജലീകരണത്തിനു വിധേയമാവുന്നു.
സ്മെക്ടൈറ്റ് വിഭാഗം. മോണ്ട്മൊറിലണൈറ്റ് ധാതുക്കളെന്നും അറിയപ്പെടുന്ന ഈ വിഭാഗം രാസികമായി പൈറോഫില്ലൈറ്റിന് ഏതാണ്ട് സമാനമാണ്.
പൊതുഘടനയോടുകൂടിയതും എന്നാല് രാസപരമായി വ്യത്യസ്തമായതുമായ ആറു ധാതുക്കള് ഈ വിഭാഗത്തിലുണ്ട്. ജാലികഘടനയില് വ്യത്യസ്ത അളവില് ജലാംശം ഉള്ക്കൊണ്ട് ഘടനാപരമായി വികസിക്കാനുള്ള ശേഷി ഇവയുടെ സവിശേഷ ഭൗതികസ്വഭാവമാണ്. തന്മൂലം ഇവയെ വീങ്ങുന്ന കളിമണ് ധാതുക്കള് (swelling clay minerals)എന്നു വിശേഷിപ്പിക്കുന്നു. ജാലികഘടനയില് ഇരുമ്പും മഗ്നീഷ്യവും ഒറ്റയ്ക്കോ ഒരുമിച്ചോ അലുമിനിയത്തെ പ്രതിസ്ഥാപനം ചെയ്യുക സാധാരണമാണ്. ഈ വിധം രൂപം കൊള്ളുന്ന, ഇരുമ്പിന്റെ ആധിക്യമുള്ള സ്മെക്ടൈറ്റ് ധാതുവിനെ നോണ്ട്രാനൈറ്റ് എന്നും മഗ്നീഷ്യത്തിന്റെ ആധിക്യമുള്ള ഇനത്തെ സാപൊണൈറ്റ് എന്നും പറയുന്നു. ഇവയ്ക്കു പുറമേയുള്ള സ്മെക്ടൈറ്റ് ധാതുക്കള് മോണ്ട്മൊറിലണൈറ്റ്, ബയ്ഡലൈറ്റ്, ഹെക്ടറൈറ്റ്, സോക്കണൈറ്റ് എന്നിവയാണ്.
ക്ലോറൈറ്റ് വിഭാഗം. പച്ച നിറത്തിലുള്ള ജലയോജിത സിലിക്കേറ്റ് ധാതുക്കളാണിവ. അഭ്രത്തിനോട് സാജാത്യം പുലര്ത്തുന്ന ക്ലോറൈറ്റ് ധാതുക്കള് ഫെറസ് ഇരുമ്പുള്ക്കൊള്ളുന്നതുമൂലമാണ് ഹരിതനിറം ആര്ജിക്കുന്നത്. ഇതു കളിമണ് ധാതുക്കളിലെ ഒരു പ്രമുഖ വിഭാഗമാണ്. കയോലിനൈറ്റ് ധാതുക്കളില് നിന്ന് ഇവയെ തിരിച്ചറിയുക പ്രയാസമാണ്. സിലിക്കണ് അയോണുകളെയും മഗ്നീഷ്യം അയോണുകളെയും അലുമിനിയം അയോണുകള് പ്രതിസ്ഥാപനം ചെയ്യുന്നതിലൂടെ രൂപംകൊള്ളുന്ന പല ക്ലോറൈറ്റ് ധാതുക്കളുണ്ട്. (നോ: ക്ലോറൈറ്റ്)
വെര്മിക്കുലൈറ്റ്. സ്മെക്ടൈറ്റ് ധാതുക്കളോട് പല തരത്തിലും സാജാത്യം പുലര്ത്തുന്ന ഒരു ധാതുവാണ് വെര്മിക്കുലൈറ്റ്. വെര്മിക്കുലൈറ്റ് ധാതുപരലുകള് സ്മെക്ടൈറ്റ് ധാതുക്കളുടേതിലും പരുത്തതാണ്. വീങ്ങുന്ന സ്വഭാവത്തില് ഇത് മറ്റുള്ളവയെക്കാള് മുമ്പിലാണ്. മുന്കാലത്ത് അഭ്രയിനങ്ങളില് ഒന്നാണെന്ന് കണക്കാക്കിയിരുന്ന വെര്മിക്കുലൈറ്റ് ഇപ്പോള് ഒരു സവിശേഷയിനം കളിമണ് ധാതുവെന്ന പദവി നേടിയിരിക്കുന്നു. 500ºC വരെ ചൂടാക്കുമ്പോള് ജാലികഘടനയില് നിന്നു ജലാംശം നിഷ്കാസിതമാവുന്നു; എന്നാല് അത് തണുത്ത്, അന്തരീക്ഷ താപനിലയിലെത്തുമ്പോഴേക്കും വീണ്ടും ജലാംശം ഘടനയ്ക്കുള്ളില് കടന്നു കൂടുന്നു. ജഫറിസൈറ്റ് (Jefferisite), കെറൈറ്റ് (Kerrite), വാലൈറ്റ് (Vaalite), പ്രാട്ടോ വെര്മിക്കുലൈറ്റ് (proto vermiculite) തുടങ്ങി പല പേരുകളിലും ഈ ധാതുവിനെ വിശേഷിപ്പിച്ചു കാണുന്നുണ്ട്. നൈസര്ഗികാവസ്ഥയില് ഉപയോഗയോഗ്യത കുറഞ്ഞ വെര്മിക്കുലൈറ്റിന് സംസ്കൃതാവസ്ഥയില് വലുതായ ഉപയോഗസാധ്യതകളുണ്ട്.
ഇല്ലൈറ്റ് വിഭാഗം. വെര്മിക്കുലൈറ്റ്, സ്മെക്ടൈറ്റ് ധാതുക്കള് എന്നിവ പോലെ അഭ്രത്തിനോട് ഘടനാപരമായി അതീവ സാജാത്യം പുലര്ത്തുന്ന ധാതുവിഭാഗമാണിത്; ഇത്തരം ധാതുക്കളെ മൊത്തത്തില് വിശേഷിപ്പിക്കാനായാണ് ഇല്ലൈറ്റ് എന്ന പദം ആദ്യകാലങ്ങളില് ഉപയോഗിച്ചിരുന്നത്. ഇന്ന് വെര്മിക്കുലൈറ്റിനെയും സ്മെക്ടൈറ്റ് ധാതുക്കളെയുംകാള് കൂടുതല് ഘടനാപരമായി അഭ്രയിനങ്ങളോട് സാദൃശ്യമുള്ള പരലുകളെയാണ് ഇല്ലൈറ്റ് ധാതുക്കളെന്ന് വിശേഷിപ്പിക്കുന്നത്. ഇല്ലൈറ്റ് ധാതുക്കളില് മസ്കവൈറ്റി(വെളുത്തയിനം അഭ്രം)ല് ഉള്ളതില് കൂടുതല് സിലിക്കയും കുറച്ച് പൊട്ടാസിയവും ആണ് ഉള്ളത്. യു.എസ്സിലെ ഒരു ഘടക സംസ്ഥാനത്തിന്റെ പേരായ ഇല്ലിനോയ് (Illinois)എന്ന പദത്തില് നിന്നാണ് ഇല്ലൈറ്റ് എന്ന പദം നിഷ്പാദിച്ചിട്ടുള്ളത്. സെറിസൈറ്റ്, ബ്രവയ്സൈറ്റ് (bravaisite), ഗ്ലിമ്മര്ട്ടണ് (glimmerton), ഹൈഡ്രാമൈക്ക, ഹൈഡ്രാ മസ്കവൈറ്റ്, ഹൈഡ്രാബയോടൈറ്റ് തുടങ്ങിയ പേരുകളിലും ഇത്തരം ധാതുക്കളെ പരാമര്ശിച്ചിരുന്നു. ഇല്ലൈറ്റ് ധാതുക്കളില് അധികപങ്കും മസ്കവൈറ്റിനോടും ശേഷിച്ചവ ബയോടൈറ്റിനോടും സാജാത്യം പുലര്ത്തുന്നവയാണ്. രാസ ഫോര്മുല: Ky Al4 (Si8-y Aly)) O20 (OH)4 [y = 1-1.5].
ഇല്ലൈറ്റ് ധാതുക്കള് വെളുത്ത നിറത്തിലോ, വിളറിയ മറ്റുനിറങ്ങളിലോ കാണപ്പെടുന്നു. ഇലക്ട്രാണ് മൈക്രാസ്കോപ്പിലൂടെ സ്പഷ്ട വിദളനം ദൃശ്യമാണ്. അപവര്ത്തനാങ്കം: 1.551.67. ചെറുതായി ചൂടാക്കുമ്പോള് ജലാംശം നിഷ്കാസിതമാവുന്നതിനോടൊപ്പം ഇവയുടെ അപവര്ത്തനാങ്കവും നേരിയതോതില് വര്ധിച്ചു കാണുന്നു; എന്നാല് വര്ധിച്ച ചൂടില് ഘടനയ്ക്കു മാറ്റമുണ്ടാവുമ്പോള് ഇത് ഗണ്യമായി കുറയുന്നു.ജാലികഘടന യഥാര്ഥത്തില് അഭ്രത്തിന്റേതുതന്നെയാണ്.
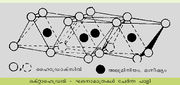
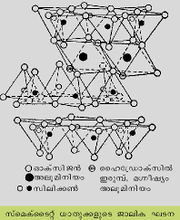
(Si Al) O4ടെട്രാഹെഡ്ര കൂടിച്ചേര്ന്നുണ്ടായിട്ടുള്ള രണ്ടു താളുകള്ക്കിടയ്ക്ക് ഒക്റ്റാഹെഡ്രല് മാതൃകയില് സമന്വയിക്കപ്പെട്ട ധനഅയോണുകളെ സംഘടിപ്പിച്ച് രൂപം കൊടുത്തിരിക്കുന്ന പാളികള് ചേര്ന്നുള്ളതാണ് ഇല്ലൈറ്റിന്റെ ജാലികഘടന.ഷെയ്ല്, ചെളിക്കല്ല് (Mud stone) എന്നിവകളിലെ പ്രമുഖ കളിമണ് ധാതുക്കള് ഇല്ലൈറ്റ് വിഭാഗത്തില്പ്പെടുന്നു. ചുണ്ണാമ്പുകല്ലിലും മറ്റിനം അവസാദങ്ങളിലും ഇവ കാണപ്പെടുന്നു. മുഖ്യമായും ഫെല്സ്പാര് ധാതുക്കളുടെയും മറ്റും രാസാപക്ഷയത്തിലൂടെ രൂപംകൊള്ളുന്ന ഇല്ലൈറ്റ് ധാതുക്കള് പ്രവാഹജലത്തിലും മറ്റും പെട്ടാണ് അവസാദന തടങ്ങളില് എത്തിക്കപ്പെടുന്നത്. അവസാദങ്ങളിലെ മറ്റു കളിമണ് ധാതുക്കളില് നിന്ന് ഡയാജനസിസ് മൂലം ഇവ രൂപംകൊള്ളാം. അപക്ഷയത്തിലൂടെയും ഉഷ്ണജലീയപ്രക്രിയകളിലൂടെയും ഉള്ള ഇല്ലൈറ്റ് ധാതുക്കളുടെ രൂപീകരണത്തിന് ക്ഷാരീയ പരിസ്ഥിതി സഹായകരമാണ്.
സെപിയൊലൈറ്റ്, അറ്റാപല്ജൈറ്റ്, പലിഗോര്സ്കൈറ്റ് വിഭാഗം. ഹോണ്ബ്ലെന്ഡ് (ആംഫിബോള്) ധാതുവിന്റേതുപോലെ ചങ്ങലയ്ക്കു സദൃശമായ ജാലികഘടനയോടു കൂടിയവയാണ് ഈ മൂന്ന് കളിമണ് ധാതുക്കള്. ഇവ മൂന്നും ഇനിയും പൂര്ണമായി പഠനവിധേയമായിട്ടില്ല. തന്തുരൂപത്തില് കാണപ്പെടുന്ന ഇവയുടെ പരലുകളില് ഘടനാപരമായി വ്യത്യസ്തമായ രണ്ടിനമുണ്ട്:
(i) അറ്റാപല്ജൈറ്റ്, പലിഗോര്സ്കൈറ്റ്; (ii) സെപിയോലൈറ്റ്. ഇരട്ട സിലിക്കകളുള്ക്കൊള്ളുന്ന ശൃംഖലകള് ഓക്സിജന് അയോണുകളില് പരസ്പരം ബന്ധിക്കപ്പെട്ടുണ്ടായതാണ് ആദ്യവിഭാഗത്തിലെ ഘടന. സെപിയൊലൈറ്റില് മൂന്നു പൈറോക്സീന്ശൃംഖലകള് കൂട്ടുചേര്ന്ന് അവിച്ഛിന്നമായ രണ്ടു ആംഫിബോള്ശൃംഖലകള്ക്ക് രൂപം നല്കിയിരിക്കുന്നു. (നോ: പൈറോക്സിന്)
ധാതു സമുച്ചയങ്ങള് (Mixed layer combination). പല കളിമണ് ധാതുക്കളുടെ ഘടനകള് കൂടിച്ചേര്ന്നിട്ടുള്ള പരല്രൂപങ്ങളും കളിമണ്ണില് ദൃശ്യമാണ്. രണ്ടുവിധത്തിലുള്ള സമ്മിശ്രണമാണ് കാണപ്പെടുന്നത്. ഒരു തരം മിശ്രണത്തില് പല ഭാഗങ്ങളും ക്രമത്തില് ആവര്ത്തിച്ചിരിക്കുന്നതു കാണാം. മറ്റൊരുതരം മിശ്രണത്തില് യാതൊരു ക്രമവുമില്ലാത്ത രീതിയില് പരല് ശകലങ്ങള് കൂടിച്ചേര്ന്നിരിക്കുന്നു.
പരല് ഘടന. അടിസ്ഥാനപരമായി, രണ്ടു ഘടനാമാത്ര(structural unit)കളുടെ വ്യത്യസ്ത സംയോജനഫലമാണ് കളിമണ് ധാതുപരലുകള്. ഒരു ഘടനാമാത്രയില് സിലിക്കാടെട്രാഹെഡ്രകള് പരസ്പരം ചേര്ന്ന പാളികളാണുള്ളത്. ഒരു സിലിക്കണ് അണുവിനു ചുറ്റുമായി സമദൂരത്തില് നാല് ഓക്സിജന് അണുക്കള് സംഘടിക്കപ്പെടുന്ന ഘടനയാണ് സിലിക്കാടെട്രാഹെഡ്രണ്. ഒരു അഷ്ടഭുജവ്യൂഹത്തില് സിലിക്കാടെട്രാഹെഡ്രകള് രണ്ടു ദിശകളില് ആവര്ത്തിക്കപ്പെടുന്ന ക്രമീകരണത്തിലൂടെയാണ് ടെട്രാഹെഡ്രല് പാളികള് സൃഷ്ടിക്കപ്പെടുന്നത്. ടെട്രാഹെഡ്രകളുടെയെല്ലാം ആധാരതലം ഒരേ പ്രതലത്തിലും സൂച്യഗ്രം ഒരേ ദിശയിലേക്കുമായിരിക്കും. കളിമണ് ധാതുക്കളിലെ ടെട്രാഹെഡ്രല് പാളിക്ക് കനം 4.93 ആങ്സ്റ്റ്രം ആണ്.
രണ്ടാമത്തെയിനം ഘടനാമാത്രയില് രണ്ടു സിലിക്കാടെട്രാഹെഡ്രകള് യോജിച്ചുണ്ടാകുന്ന ഒക്റ്റാഹെഡ്രല്മാത്രകള് ചേര്ന്നുള്ള പാളികളാണ് രൂപംകൊള്ളുന്നത്. ഇവിടെ ഓരോ പാളിക്കും 5.05 ആങ്സ്റ്റ്രം കനമുണ്ടാകും.
ആകൃതി. അടിസ്ഥാനഘടനാമാത്രകളായ പാളികളുടെ സ്ഥൂലരൂപത്തിലുള്ള ആവിഷ്കരണമാണ് കളിമണ് ധാതുപരലുകള്. തന്മൂലം പരലുകള്ക്കും പാളികള് പോലുള്ള ആകൃതിയാണുള്ളത്. ചില ധാതുപരലുകളില് അഷ്ടഭുജരൂപരേഖയും വ്യക്തമാണ്. ചില ധാതുക്കള് സാരണീബദ്ധമോ, നീണ്ടുനേര്ത്തതോ ആണ്. ചിലവ തന്തുരൂപത്തിലും കാണപ്പെടുന്നു.
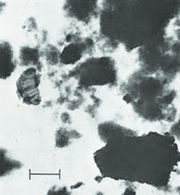
ഇലക്ട്രാണ് മൈക്രാസ്കോപ്പിന്റെ ആവിര്ഭാവം അതിസൂക്ഷ്മമായ കളിമണ്ധാതുപരലുകളുടെ ആകൃതി മനസ്സിലാക്കുന്നതിന് സഹായകമായിത്തീര്ന്നു; പരലുകളുടെ 15,000 ഇരട്ടി ആവര്ധിതമാക്കപ്പെട്ട ദൃശ്യം ഇവ ലഭ്യമാക്കുന്നു. ഇവയുടെ ഫോട്ടോമൈക്രാഗ്രാഫ് വീണ്ടും പല മടങ്ങ് വലുതാക്കിയശേഷമുള്ള പഠനം പരലാകൃതിയും മറ്റും കൂടുതല് വ്യക്തമാക്കാനുതകുന്നു.
രാസഭൗതിക സ്വഭാവം അയോണ് വിനിമയം. കളിമണ്ധാതുക്കള്ക്ക്, ജാലികഘടനയില് ധനഅയോണുകളും ഋണഅയോണുകളും വിനിമയാവസ്ഥയില് നിലനിര്ത്താനുള്ള അനുപമമായ ശേഷിയുണ്ട്. സീമാന്തഭാഗങ്ങളിലെ ടെട്രാഹെഡ്രന് അഥവാ ഒക്റ്റാഹെഡ്രന് മാത്രകളിലെ ഭഞ്ജിതബന്ധനങ്ങള് (broken bonds) സൃഷ്ടിക്കുന്ന അസന്തുലിത ചാര്ജുകള് ഇത്തരം ധന, ഋണഅയോണുകളുടെ ആഗിരണം മൂലമാണ് സമീകരിക്കപ്പെടുന്നത്. ജാലികഘടനയ്ക്കുള്ളില്ത്തന്നെ, അസന്തുലനം സൃഷ്ടിക്കത്തക്ക തരത്തില് നടക്കുന്ന പ്രതിസ്ഥാപനവും കളിമണ് ധാതുവിന് ഈ ശേഷി നല്കുന്നു. കളിമണ് ധാതുക്കള് സാധാരണയായി വിനിമയം ചെയ്യുന്ന ധനഅയോണുകള് Ca2+, Mg2+, H+, K+, NH4+, Na+ എന്നിവയാണ്. സാധാരണ കാണപ്പെട്ടിട്ടുള്ള ഋണഅയോണുകള് SO42-, Cl , PO43-, NO3 എന്നിവയുമാണ്.
അയോണുകളെപ്പോലെ കളിമണ് ധാതുക്കള്ക്ക് ജലാംശവും ഉള്ക്കൊള്ളാനുള്ള ശേഷിയുണ്ട്. കളിമണ് ധാതുക്കളില് രണ്ടു വിധത്തിലുള്ള ജലാംശമുണ്ട്. ഘടനയ്ക്കുള്ളില്ത്തന്നെയുള്ള വിള്ളലുകളിലും മറ്റും കടന്നുകൂടുന്ന ജലാംശം 100-150ºC വരെ ചൂടാക്കുമ്പോള് നിഷ്കാസിതമാവുന്നു. ഇതിനു പുറമേ കളിമണ് ധാതുക്കളിലെല്ലാം തന്നെ ഹൈഡ്രാക്സില് ഒരു മുഖ്യഘടകമാണ്. തന്മൂലം ചൂടാക്കുമ്പോള് രണ്ടു ദശകളിലായി കളിമണ് ധാതുക്കള്ക്ക് നിര്ജലീകരണം സംഭവിക്കുന്നു (നോ: കളിമണ്ണ്). 400-700ºC വരെ ചൂടാക്കുമ്പോള് ഹൈഡ്രാക്സില് കൂടി നിഷ്കാസിതമാവുന്നതിലൂടെ ജാലിക ഘടനയില്ത്തന്നെ മാറ്റമുണ്ടാകുന്നു. കളിമണ് ധാതുക്കള്ക്ക് ജൈവപദാര്ഥങ്ങളുമായി രാസികമായി പ്രതിപ്രവര്ത്തിക്കാനുള്ള ശേഷിയുണ്ട്.
എല്ലാത്തരം കളിമണ് ധാതുക്കളും മണ്ണില് ദൃശ്യമാണ്. ഭൗമായുസ്സില്, ചില കാലങ്ങളില് രൂപംകൊണ്ട അവസാദ സ്തരങ്ങളില് ചിലയിനം കളിമണ് ധാതുക്കള് കൂടുതലായി കാണപ്പെടുന്നു. സെറാമിക് വ്യവസായം, എണ്ണവ്യവസായം, കടലാസ് വ്യവസായം, ലോഹസംസ്കരണവ്യവസായം തുടങ്ങിയ മേഖലകളില് കളിമണ് ധാതുക്കള്ക്ക് വലുതായ ഉപയോഗസാധ്യതകളുണ്ട്. നോ: കളിമണ് കലാരൂപങ്ങള്; കളിമണ് വ്യവസായം